今回は以前に公開させていただいた「活動電位」について、Na+、K+、Ca2+が主役として執筆させていただきました。
今回のテーマは「Cl-」ですが、どの参考書を読んでもCl–やMg2+について記載されているところをあまり見かけません。
しかし、Cl–についてはイオン濃度としてよく表に掲載されていて、血中濃度的にも主要な電解質として存在しているにも関わらず、活動電位の項では触れられることはほとんどありません。
また、血ガスや採血データにおいても、Na+、K+、Ca2+などがどうしても重視され、Cl–やMg2+を軽視しがちです。
筆者としてもCl–やMg2+についてどのような役割があるのか気になったのでまとめることにしました。
今回はCl–についてまとめており、別記事でMg2+についてまとめております。
膜電位に関わるイオン
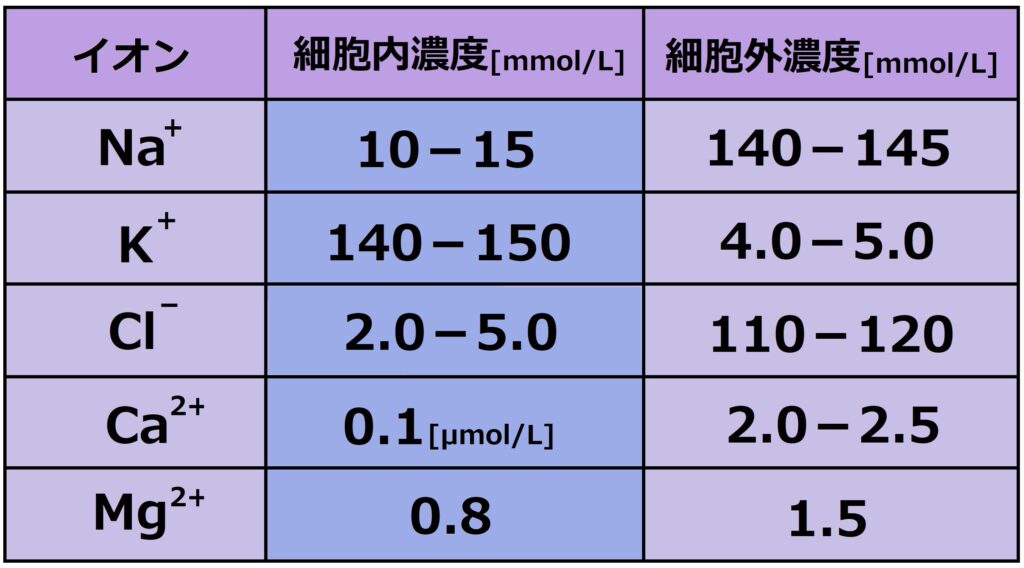
以前に執筆した記事では、静止膜電位や活動電位に関連するイオンは、Na+、K+、Ca2+、Cl–の4種類を掲載しました。ここで、細胞内外の上記イオンの濃度を確認しておきます。
細胞内のイオン濃度は、普段の採血で見るデータと全然異なることに注目ですね。
Mg2+には諸説あり、調べても細胞内濃度、細胞外濃度については様々な値が散見されました。
私自身も単位変換や計算を尽くして比較しつつ調べましたが、2023年11月現在では確信には至っておりません。
現時点では図の数値で進めさせていただきます。蛋白結合等を含めた総Mg濃度とイオンのみの遊離Mg2+濃度という2つの表現がありますので、お調べになる際はこの点にご注意ください。
読者の皆さんで正しい数値や情報お持ちでしたらご意見いただけたら幸いです。
ただし、報告の際は単位と上記の総Mg濃度なのか遊離Mg2+濃度なのかにご注意いただきますようお願い致します。
Cl–の役割
まず、Cl–からですが、この電解質は日常的には「クロール」や「クロライド」と呼ばれており、細胞外液に多く存在する陰イオンであり、血清の総陰イオンの約70%を占める血液中で最も重要な陰イオンの一つとなっています。
血清Cl–濃度はおおよそ100-110[mmol/L]、細胞内濃度は2.0-5.0[mmol/L]程度となり、生体内のほとんどが細胞外に存在しています。
Cl–の主な役割は、他の電解質と相互作用し、酸塩基平衡の調整、浸透圧の調節、筋活動、胃酸の成分、酵素活性化、好中球貪食作用など多岐に渡ります。
重要なのはCl–単独の異常で症状が出るのではなく、他の電解質異常が伴って症状が出現するということです。
では、Cl–の役割についてそれぞれ説明します。
酸塩基平衡の調整
Cl–は血清総陰イオンの大半を占めます。そのため、Cl–は総陰イオンの調整を担っています。
Cl–の調整機構としては、腎尿細管での再吸収があります。
また、クロール・重炭酸塩移動(chloride-bicarbonate shift)というのがあります。Cl–が減少するとHCO3–が増加し、Cl–が増加するとHCO3–が減少するといったように、陰イオンの総和が一定に保つように働いています。
臨床上はAG(anion gap:アニオンギャップ)にて特に代謝性アシドーシスの原因鑑別する指標に利用されます。AGは血中の陽イオン(カチオン)と陰イオン(アニオン)の差のことであり、AGを求める式は以下の通りです。
AG = [Na+] - { [Cl–] + [HCO3–]}
基準値はAG=12±2[mmol/L]ですが、上記をNa+=140[mmol/L]、Cl–=104[mmol/L]、HCO3–=24[mmol/L]としたときに算出されるものです。
別の視点からAGを見てみます。上記AGの式を変形させて、
\begin{align}
[Na^+]-[Cl^-] &= AG+[HCO_3^-]\\
&=12+24\\
&=36
\end{align}
となります。
AGが特に有用となるのは、通常測定できない代謝性酸の陰イオンの蓄積を伴う乳酸アシドーシスや糖尿病ケトアシドーシスなどの高アニオンギャップ性代謝性アシドーシスの精査に繋がるというところです。
- エチレングリコール
- ピログルタミン酸(5-オキソプロリン)
- 乳酸
- メタノール
- アスピリン
- 腎不全
- 横紋筋融解症
- ケトアシドーシス
浸透圧の調節
血液の浸透圧が290[mOsm/L]としたとき、Cl–は約1/3を占めるので、浸透圧維持に大きく貢献していると言えます。
筋活動
神経や筋肉のような興奮性細胞にはCl–を調節するチャネルが存在しています。
ここでは詳細は省きますが、Cl–の細胞内流入は神経・筋肉の興奮性を抑制する働きがあるようです。
胃酸成分
Cl–は胃酸HClの成分でもあります。
ペプシノーゲンからペプシンへの活性化、ペプシンの至適pHの維持、鉄(3価)をイオン化して腸管からの吸収促進、摂食食物の殺菌作用があります。
CO2 + H2O ⇔ HCO3– + H+
H+ + Cl– → HCl
酵素活性化
アミラーゼやウレアーゼの活性化の働きがあります。
好中球貪食作用
好中球の酵素により次亜塩素酸となり、好中球の貪食作用に関与しています。
好中球ペルオキシダーゼ Cl– + H2O2 → OCl– + H2O
Cl–異常値での病態
Cl–異常値(低値・高値)での病態としては以下などが挙げられます。
- 低Cl–
-
- 嘔吐(喪失)
- 腎性喪失(呼吸不全)→ 呼吸性アシドーシス、代謝性アルカローシス
- 水分過剰
- 低張性脱水
- ADH分泌異常症候群
- 原発性アルドステロン症
- 副腎皮質機能低下症
- 高Cl–
-
- 酸塩基平衡障害(代謝性アシドーシス、呼吸性アルカローシス)
- 水分摂取障害(意識障害、消化管疾患、脳腫瘍等による口渇中枢障害)
- 水分喪失
- Cl–過剰投与
- 高張性脱水
- 下痢
- 副腎皮質機能亢進症
- 低蛋白血症
Cl–の濃度勾配と活動電位
Cl–の細胞外濃度は110-120[mmol/L]、細胞内濃度は2.0-5.0[mmol/L]という濃度差が生じていますが、この濃度勾配が静止膜電位や活動電位発生に関与しています。
細胞内の極端に低いCl–濃度がどのように調整されているのかを説明します。
Cl–調整の膜タンパク質
細胞内のCl–濃度を調整しているのは、Na+-K+-2Cl−cotransporter(NKCC2:Na+-K+-2Cl–共輸送体)、Na+-Cl−cotransporter(NCC:Na+-Cl–共輸送体)、K+-Cl−cotransporter(KCC:K+-Cl–共輸送体)という膜タンパク質の存在によるものです。
主に尿細管でのCl–再吸収の話で出てくる膜タンパク質です。
ループ系利尿剤はNKCC2を抑制する働きがあり、Na+やK+やCl–の再吸収を抑制することで尿細管細胞内Na+濃度が減少し、血管側に存在するNa+/K+-ATPaseの活性が低下し、Na再吸収が抑制され、利尿作用及び降圧効果が得られるのです。
話が少し逸れましたが、上記膜タンパク質の機能を説明します。
- Na+-K+-2Cl−cotransporter(NKCC2)
-
細胞外の1つのNa+、1つのK+、2つのCl–とを細胞内へ共輸送する ※非興奮性細胞で優位
- Na+-Cl−cotransporter(NCC)
-
細胞外の1つのNa+、1つのCl–を細胞内へ共輸送する ※非興奮性細胞で優位
- K+-Cl−cotransporter(KCC)
-
細胞内の1つのNa+、1つのCl–を細胞外へ共輸送します。 ※興奮性細胞で優位
上記のように一見、細胞内のCl–を細胞外へ汲み出す作用の方が強そうに思えますが、実は神経や筋肉のような興奮性細胞ではKCCが優位、非興奮性細胞ではNKCC とNCCが優位であるという特性があるために、心筋細胞では細胞内のCl–が低く保たれているのです。
もう少し詳しく説明しますと、K+の平衡電位は-90[mV]でしたが、Cl–の平衡電位は-60~75[mV]と変動幅があります。
というのも、Cl–はK+のように濃度を一定にする機構が無く、細胞の電位差によって受動的に決定されおり、K+の平衡電位が静止膜電位に近しい値なのは、静止膜電位を決定しているのがK+ということを示しているからです。
活動電位におけるCl−の役割は?
結局のところ、活動電位におけるCl–の役割はといいますと、神経細胞や筋肉細胞ではKCCのようなアニオンチャネルの開口によってCl–が細胞内へ流入させ、細胞内電位をより陰性へ下げることで静止膜電位の維持に関与しています。
さいごに
以上で、Cl–についての説明になります。
やはり血ガスや採血データにおいても、Na+、K+、Ca2+などがどうしても重視され、Cl–やMg2+を軽視しがちです。
AGに関しては集中治療領域では利用できるものなので覚えておいても良いはずです。
Mg2+の記事もよろしくお願いします。

















コメント